Les
recherches, pour le moment, montrent qu'il est difficile de trouver une relation
entre l'odeur ou la saveur et la constitution chimique de la molécule
aromatique. Plusieurs caractéristiques semblent intervenir : la présence
de groupes osmophores, la nature des liaisons, la présence d'un cycle
et l'influence de la géométrie des molécules.
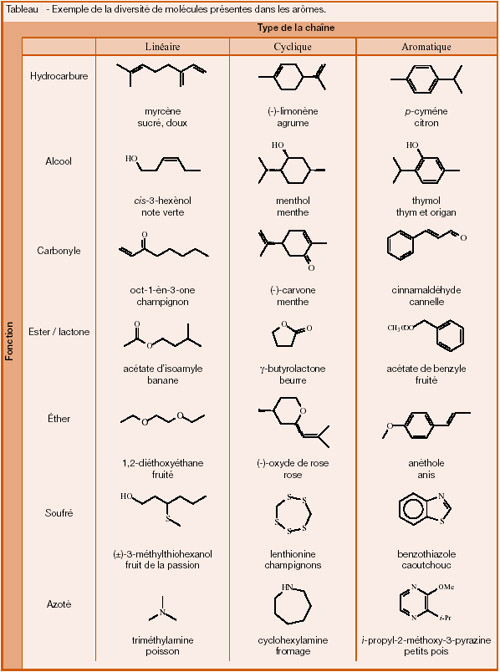
Les
molécules responsables de l'arôme sont constituées d'un
squelette hydrocarboné qui peut être :
Cependant, la présence d'un même groupe osmophore dans des molécules
différentes n'entraîne pas nécessairement l'analogie d'odeur.
Ainsi,
le propénal, ou acroléine (CH2=CH–CHO)
dégage une odeur âcre et irritante, alors que l'aldéhyde
cinnamique (C6H5–CH=CH–CHO),
répand
une odeur agréable de cannelle, bien que ces deux substances renferment
le même groupe osmophore, représenté par -CHO.
La présence de liaisons insaturées
La
présence de liaisons insaturées dans
une molécule a également une grande influence sur l'odeur.
Ainsi,
l'ester acétylénique (CH3–[CH2]4–CH=CH–COOCH3)
présente une odeur de violette, tandis que l'ester saturé correspondant
(CH3–[CH2]6–COOCH3)
n'a qu'une odeur fruitée.
L'influence d'un cycle
La
présence d'un cycle dans une molécule exerce aussi un effet
favorable sur l'odeur; l'estérification intramoléculaire des
acides alcools, en donnant des lactones, renforce l'odeur, et les composés
cycliques ou bicycliques azotés sont souvent odorants.
Par exemple, l'anthranilate de méthyle, l'indole (constituants de l'essence
de la fleur d'oranger), le scatole (constituant de l'odeur de civette), etc.,
ont des odeurs puissantes.
L'influence de la position du groupe osmophore
La
position d'un groupe osmophore dans une même molécule a aussi
une grande importance. Ainsi, les ionones N et ß, cétones isomères
de formule C13H20O,
qui ne diffèrent que par la position de la double liaison cyclique,
ont des odeurs de violette d'intensités très différentes.
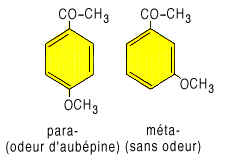
Parmi
les dérivés de la série benzénique portant deux
substituants à la place de l'hydrogène, de nombreux isomères
ortho- ou para- sont odorants, tandis que les isomères méta-
correspondants le sont rarement.
L'influence de la géométrie des molécules
Divers
travaux ont montré que des facteurs géométriques interviennent
également: des molécules de mêmes dimensions ont souvent
des odeurs voisines, indépendamment de la nature des groupes osmophores
qu'elles renferment. Ainsi, le benzaldéhyde (C6H5–CHO), le nitrobenzène
(C6H5–NO2) et le benzonitrile (C6H5–C©N) présentent
tous trois une odeur d'amande amère.
De
même, les composés à cycles moyens ou à grands
cycles comportant de 9 à 20 chaînons carbonés sont doués
d'une odeur camphrée (de 9 à 12 chaînons), musquée
(15 ou 16 chaînons) ou à note animale (de 16 à 20 chaînons);
l'odeur s'atténue et disparaît au-delà de 20 chaînons.